روابط شيميایی
فصل چهاردهم
1 K. N. Toosi University of Technology Thermodynamics II
سوخت و احتراق
هر ماده اي كه در حين سوختن انرژي آزاد كند، سوخت ناميده مي شود.
اكثر سوخت هاي شناخته شده شامل هيدروژن و كربن هستند كه سوخت هاي
هيدروكربني ناميده مي شوند. (به عنوان مثال: زغال سنگ، بنزين، گاز طبيعي)
اكثر سوخت هاي هيدروكربني مايع مخلوطي از
تعداد زيادي هيدروكربن هستند كه از نفت خام به
وسيله تقطير در برج تقطير بدست مي آيند.
2 K. N. Toosi University of Technology Thermodynamics II
سوخت و احتراق
احتراق: يك واكنش شيميايي كه طي آن سوخت اكسيد مي شود و
مقادير زيادي انرژي آزاد مي شود، احتراق نام دارد.
به دليل فراواني هواي آزاد، در اغلب فرآيندهاي احتراق هوا به عنوان
اكسيد كننده مورد استفاده قرار مي گيرد.
در موارد خاص بايد از اكسيژن خالص به عنوان اكسيد كننده استفاده
نمود.
3 K. N. Toosi University of Technology Thermodynamics II
تركيبات هوا
% هواي خشك از 20.9 % اكسيژن، 78.1 % نيتروژن، 0.9
آرگون و مقادير كمي دي اكسيد كربن، هليم، نئون و
هيدروژن تشكيل شده است.
در تحليل هواي خشك، 21 درصد مولي اكسيژن و 79
درصد مولي نيتروژن در نظر گرفته مي شود.
بنابراين همراه هر مول اكسيژن هوا در فرآيندهاي
3 مول نيتروژن وجود خواهد داشت. / احتراق، 76
4 K. N. Toosi University of Technology Thermodynamics II
فرآيند احتراق
در طي يك فرآيند احتراق، اجزايي كه قبل از واكنش وجود دارند واكنشگرها
و اجزايي به بعد از واكنش بوجود مي آيند محصولات ناميده مي شوند.
5 K. N. Toosi University of Technology Thermodynamics II
نسبت هوا به سوخت
نسبت » نسبت هوا به سوخت معمولالا بر اساس جرم بيان مي شود و به صورت
تعريف مي شود. « جرم هوا به جرم سوخت در طي فرآيند احتراق
نسبت هوا به سوخت همچنين بر مبناي مولي به صورت نسبت تعداد مول هاي
هوا به تعداد مول هاي سوخت تعريف مي شود.
6 K. N. Toosi University of Technology Thermodynamics II
احتراق نظري و واقعي
هر گاه تمام اجزاء قابل احتراق سوخت در يك فرآيند احتراق به طور كامل
بسوزند، فرآيند احتراق كامل است.
متقابلا هر گاه محصولات احتراق شامل هر مقدار سوخت نسوخته و يا
باشند، فرآيند احتراق ناقص است. OH و CO,H2 , C اجزايي مثل
كافي نبودن اكسيژن، كافي نبودن عمل مخلوط شدن در محفظه احتراق و
پديده گسستگي از دلالايل بروز احتراق ناقص مي باشد.
احتراق كامل
7 K. N. Toosi University of Technology Thermodynamics II
احتراق نظري و واقعي
كمترين ميزان هواي مورد نياز براي احتراق كامل يك سوخت، هواي نظري
يا استوكيومتريك ناميده مي شود.
فرآيند احتراق كه در آن سوخت به طور كامل با هواي نظري مي سوزد،
احتراق نظري يا استوكيومتريكآن سوخت ناميده مي شود.
احتراق استوكيومتريك متان
8 K. N. Toosi University of Technology Thermodynamics II
احتراق نظري و واقعي
در صورتي كه هواي موجود بيش از هواي نظري باشد، ميزان هواي مازاد
به صورت درصد هواي اضافي يا درصد هواي نظري بيان مي شود.
مقدار هواي كمتر از هواي نظري، كمبود هوا ناميده مي شود و اغلب به
صورت درصد كمبود هوا بيان مي شود.
در صورتي كه فرآيند احتراق كامل فرض شود، با استفاده از اصل بقاي
جرم مي توان تركيبات محصولات را بدست آورد.
9 K. N. Toosi University of Technology Thermodynamics II
انرژي ملكول هاي ماده
اشكال مختلف انرژي موجود در
مولكول هاي يك سيستم عبارتند از:
انرژي محسوس
انرژي نهان
انرژي شيميايي
انرژي هسته اي
10 K. N. Toosi University of Technology Thermodynamics II
در يك فرآيند كه واكنش شيميايي وجود داشته باشد تغيير انرژي
شيميايي نيز رخ مي دهد.
در صورتي كه اتم هاي هر واكنش گر دست نخورده
باقي بمانند و با چشم پوشي از تغييرات انرژي
جنبشي و پتانسيل، تغييرات انرژي يك سيستم در
يك واكنش شيميايي ناشي از تغيير در حالت و
تغيير در تركيب شيميايي خواهد بود:
11 K. N. Toosi University of Technology Thermodynamics II
آنتالپي واكنش و آنتالپي احتراق
ميزان انتقال گرما در يك واكنش شيميايي بدون انجام كار، آنتالپي
واكنش ناميده مي شود و به صورت اختلاف بين آنتالپي محصولات و
آنتالپي واكنشگرها مي باشد.
براي فرآيندهاي احتراق معمولا آنتالپي واكنش، آنتالپي احتراق ناميده
مي شود.
12 K. N. Toosi University of Technology Thermodynamics II
آنتالپي واكنش ؛ آنتالپي احتراق
13 K. N. Toosi University of Technology Thermodynamics II
آنتالپي تشكيل
آنتالپي واكنش تشكيل يك ماده از عناصر تشكيل دهنده اش را آنتالپي تشكيل
آن ماده مي نامند.
براي تمام عناصر پايدار آنتالپي تشكيل صفر است.
آنتالپي تشكيل
14 K. N. Toosi University of Technology Thermodynamics II
ارزش حرارتي
مقدار انرژي آزاد شده وقتي كه يك سوخت بطور كامل در طي يك فرآيند
جريان ثابت مي سوزد و محصولات به حالت مواد واكنشگر باز مي گردند،
ارزشحرارتي سوخت ناميده مي شود.
در صورتي كه در محصولات آب به صورت مايع باشد ارزش حرارتي بالاتر
و در صورتي كه آب به صورت بخار باشد ارزش حرارتي پايين تر ناميده
مي شود و داريم:
15 K. N. Toosi University of Technology Thermodynamics II
تحليل قانون اول براي سيستم هاي واكنشي
براي نوشتن موازنه انرژي نياز به دانستن آنتالپي اجزاي ماده مي باشد.
آنتالپي يك ماده مركب به صورت زير نمايش داده مي شود:
آنتالپي محسوس نسبت به حالت استاندارد
16 K. N. Toosi University of Technology Thermodynamics II
تحليل قانون اول براي سيستم هاي واكنشي جريان پايدار
بقاي انرژي براي يك سيستم واكنشي شيميايي جريان پايدار
براي واكنشي كه آنتالپي احتراق در دسترس مي باشد:
17 K. N. Toosi University of Technology Thermodynamics II
تحليل قانون اول براي سيستم هاي واكنشي- سيستم بسته
بقاي ان ژي ب اي س تم ب ته واكنش ش م اي
واكنشي انرژي براي سيستم بسته شيميايي 18 K. N. Toosi University of Technology Thermodynamics II
دماي شعله آدياباتيك
در حالتي كه هيچ اتلالاف گرمايي به محيط اطراف وجود نداشته باشد، دماي
محصولات به يك مقدار ماكزيمم خواهد رسيد كه دماي شعله آدياباتيك
يا دماي احتراق آدياباتيكواكنش ناميده مي شود.
19 K. N. Toosi University of Technology Thermodynamics II
20 K. N. Toosi University of Technology Thermodynamics II
تغيير آنتروپي سيستم هاي واكنشي
تعادل آنتروپي براي يك سيستم واكنشي بسته يا جريان پايدار
اصل افزايش آنتروپي
21 K. N. Toosi University of Technology Thermodynamics II
آنتروپي مطلق
قانون سوم ترموديناميك: آنتروپي يك ماده كريستالي خالص در دماي
صفر مطلق، برابر با صفر است.
آنتروپي مطلق: مقادير آنتروپي نسبت به مبناي عمومي براي آنتروپي
(قانون سوم ترموديناميك) آنتروپي مطلق ناميده مي شود.
22 K. N. Toosi University of Technology Thermodynamics II
كار برگشت پذير
تغيير در قابليت انجام كار يك سيستم طي يك فرآيند، كار برگشت پذير
ناميده مي شود:
در صورتي كه هم واكنش گر ها و هم محصولات در دماي محيط اطراف
باشند با استفاده از تعريف تابع گيبس داريم:
23 K. N. Toosi University of Technology Thermodynamics II
ارسال نظر برای این مطلب
اطلاعات کاربری
لینک دوستان
آرشیو
آمار سایت


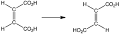 آزمایش ایزومراسیون
آزمایش ایزومراسیون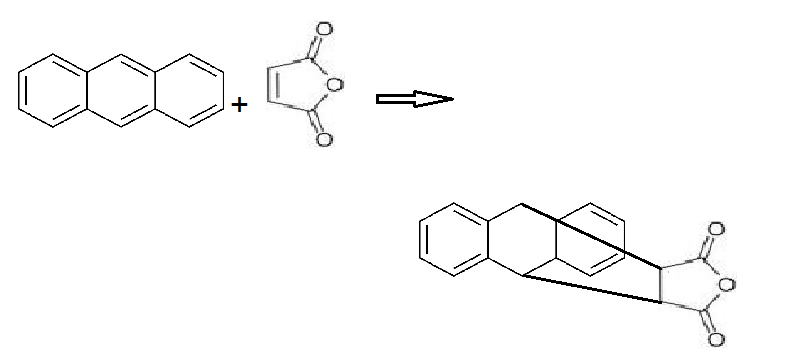 آزمایش دیلز آلدر
آزمایش دیلز آلدر